
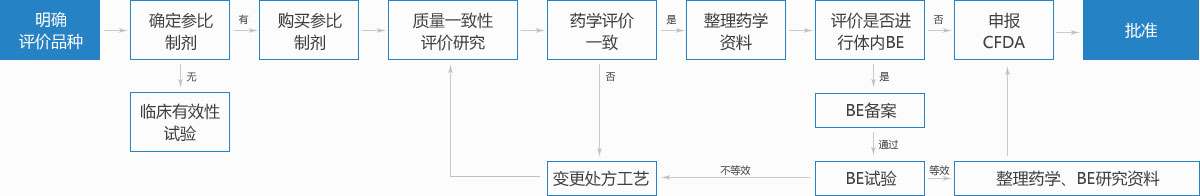
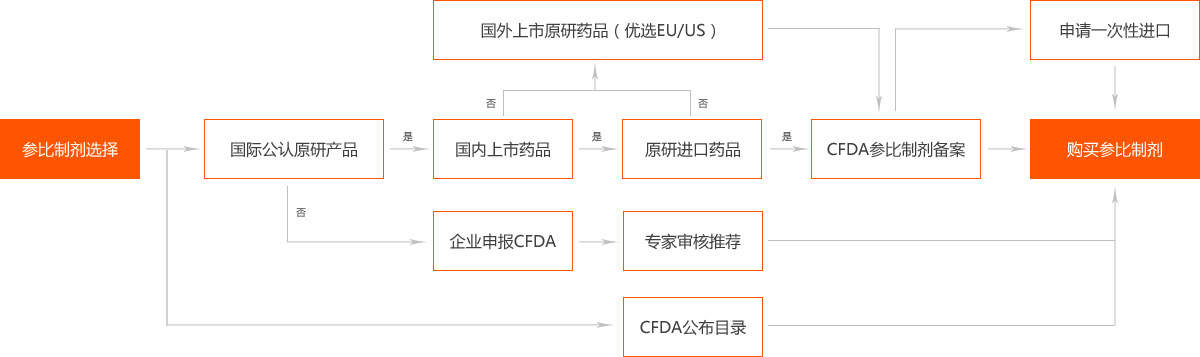
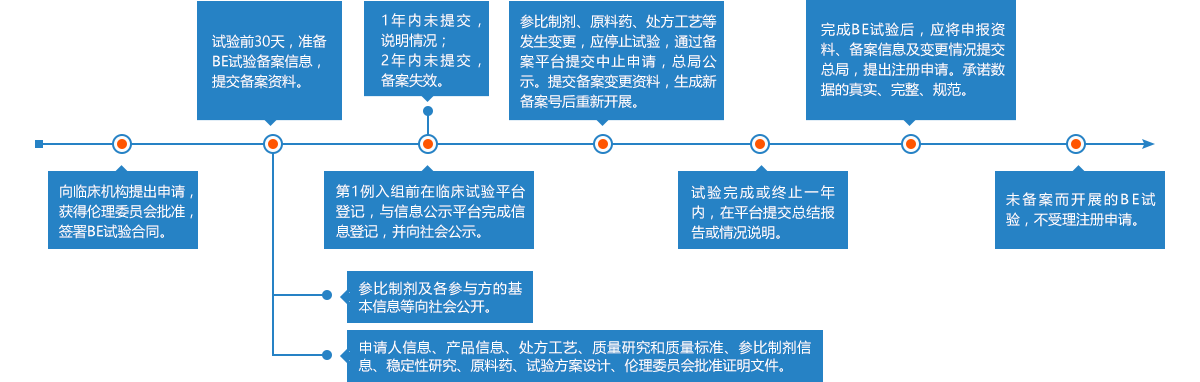
首先进行2007年10月1日前批准的国家基本药物目录(2012年版)中化药仿制口服固体制剂——2018年底之前完成一致性评价,否则不予再注册。
通过质量一致性评价的仿制药允许其在说明书和标签上予以标注,招标中优先采购,临床用优先选用,医保报销等给予支持。
其他仿制药在首家通过一致性评价后3年内不通过评价的,不予再注册。
企业可以申报作为该品种的药品上市许可持有人,委托其他药品生产企业生产。
同一品种3家以上通过一致性评价,招投标中不予考虑未通过的。
发改委,工信部对企业的技术改造给予支持。
率先引入世界先进的项目集成管理体系IPD,保证项目里程碑与关键节点按时有效达成;研发企业首家通过ISO9001国际质量管理体系认证,确保研发过程的完整性、规范性与一致性。
国内研发企业率先引入世界先进的色谱管理系统Waters Empower 3,引入实验室信息管理系统 Watson LIMS,确保了研发数据的真实性、完整性、可追溯性。
超强的转化能力:拥有先进的原料药/制剂GMP中试生产基地,所有转让项目均经过中试研究放大与验证,确保工艺成熟稳定,为成功转化打下基础。
20年的专业研发经验:拥有520余人的专业研发团队及20年积淀的新药研发和申报经验,是国内获得新药证书最多的新药研发企业。
全生命周期一站式技术服务:致力于为客户打造从产品战略咨询、原料研发与关联登记、药学研究、BE研究、工艺放大与验证、上市后不良反应监测的全生命周期一站式服务
先进的研发平台:一万余平米行业领先实验室,投资数亿元购置先进试验设备,十余个经过验证的技术平台,打造核心硬实力
客户见证:长期合作伙伴超200家,其中包括行业前100位的企业50余家,上市企业60余家
上市公司,值得信赖(百诺医药股票代码:836534)